Als in een bijenraat liggen ze, elk in een eigen microvakje: honderden prille synthetische menselijke embryo’s. Aan hun ontstaan is geen ei- of zaadcel te pas gekomen. Uit de huidcellen van een Britse vrouw zijn ze gemaakt, cellen die zijn teruggeprogrammeerd naar stamcellen die tot alle mogelijke weefsels kunnen uitgroeien.
Die stamcellen hebben zich geordend tot een klompje cellen, net zoals een embryo tijdens een zwangerschap. Ze hebben een laagje andere cellen gevormd, als een blaasje om het embryo heen, die een placenta kunnen vormen. En er is zelfs een derde laag cellen, de aanleg van de dooierzak, die een embryo in de eerste weken van voeding voorziet. Alles dankzij de juiste cocktail van signaalmoleculen en groeibevorderende stoffen in hun bijenraat.
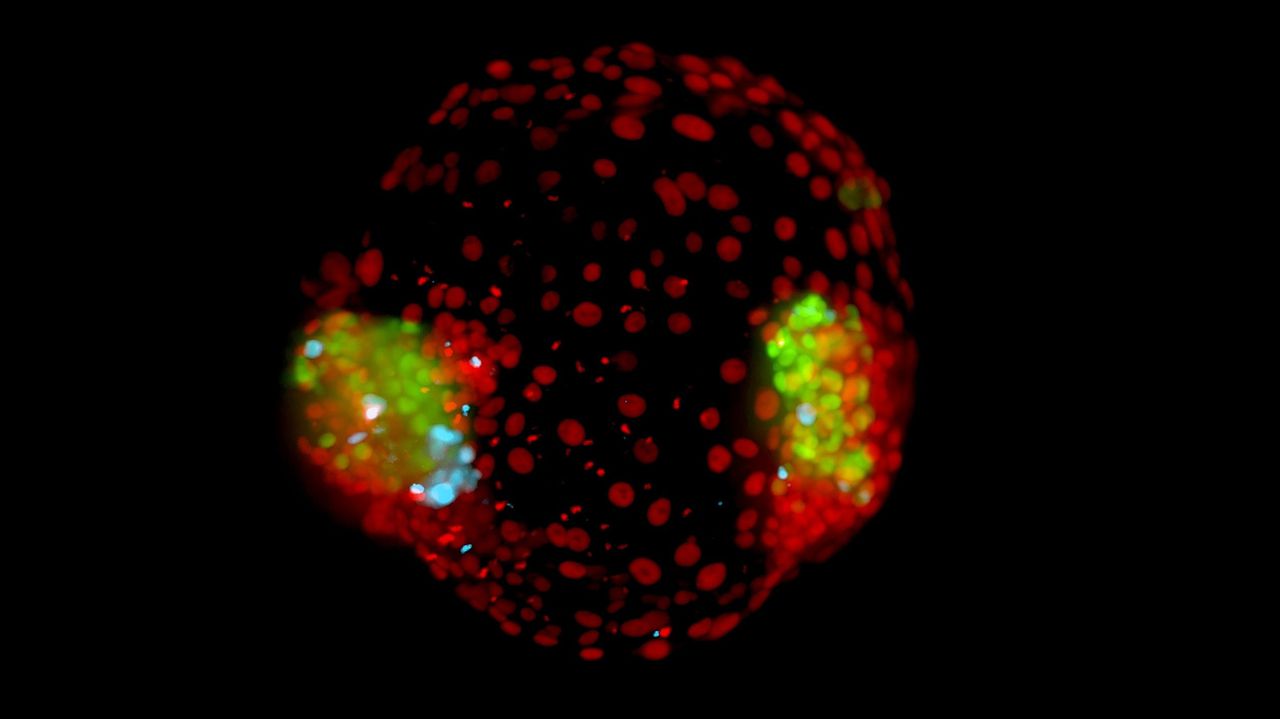
En alsof dit huzarenstuk al niet genoeg is: één op de vijf microvakjes bevat een kunstmatige eeneiige tweeling.
/s3/static.nrc.nl/images/gn4/stripped/data114036048-20872c.jpg|https://images.nrc.nl/QdPRDmnvz7RLwuHA2IDGx1zP7PY=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data114036048-20872c.jpg|https://images.nrc.nl/NULdqKDcbUSZ4QfU9NyUSp1frKM=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data114036048-20872c.jpg)
Zijn het échte embryo’s? Nee. Blastoïden, noemen de wetenschappers van het MUMC+ en het MERLN Instituut in Maastricht ze. Embryoachtige structuren. En ze zijn niet bedoeld om grote aantallen nieuwe mensjes te kweken. Het zijn modellen. „Voor het eerst is het hiermee mogelijk om te bestuderen hoe eeneiige tweelingen zich in die allervroegste eerste dagen ontwikkelen”, vertelt projectleider en biomedisch ingenieur Erik Vrij tijdens een rondgang door het instituut. „We kunnen hiermee leren wat er nodig is voor een gezonde innesteling in de baarmoeder, en zo bijvoorbeeld ivf-behandelingen te verbeteren.”
Doorzichtig plastic
De honderden embryo’s zijn te zien onder een microscoop in een van de labs van het MUMC+. En wie zijn blik niet door de oculairen van de microscoop richt maar met het blote oog eronder kijkt, realiseert zich dat het er nog bijna honderd keer meer zijn. Al die levende celklompjes zitten nog maar in één van de 96 kuipjes van een handzame kweekplaat van doorzichtig plastic.
Die plaat is een belangrijke troef van het instituut. Daarin kunnen de levende embryo’s dagenlang worden gefilmd om de ontwikkeling in kaart te brengen. De cellen die het embryo vormen zijn met een moleculaire techniek zo gemarkeerd dat ze onder een fluorescentiemicroscoop groen licht afgeven, en de cellen die de placenta vormen rood. De plaat is een uitvinding van Vrij’s collega, Stefan Giselbrecht. Ze publiceerden op 10 april samen met collega’s hun primeur, eeneiige tweelingembryo’s, in wetenschappelijk tijdschrift Advanced Materials.
„Duizenden embryo’s kunnen we zo screenen”, zegt Vrij. „We kijken onder meer naar het effect van toxische stoffen en van chromosomale afwijkingen. Door de grote aantallen embryo’s kunnen we goede statistische analyses doen.”
De onderzoekers van het MERLN instituut waren in 2018 de eersten ter wereld die een blastoïde hadden gemaakt, een kunstembryo van muizenstamcellen. In de jaren daarna kwam de ene na de andere onderzoeksgroep met zulke modelembryo’s, niet alleen van muizen, maar ook van apen. En in juni 2023 wisten vier onderzoeksgroepen in het Verenigd Koninkrijk, Israël, de Verenigde Staten en China niet hoe snel ze elk hun resultaten met menselijke kunstembryo’s wereldkundig moesten maken.
En nu zijn er dus de tweelingembryo’s. „Hoe eeneiige tweelingen ontstaan was tot nu toe een raadsel”, zegt Vrij. „Ergens in de ontwikkeling splitst het klompje cellen in een bevruchte eicel zich tot twee klompjes. Bij een derde van de eeneiige tweelingen krijgt elk embryo zijn eigen placenta en vruchtzak, maar vaker delen ze de placenta. Daarbij treden vaker complicaties op.” Wetenschappers vermoedden dat het moment waarop de splitsing plaatsvindt bepalend is voor het al dan niet delen van de placenta. Met de Maastrichtse kunsttweelingembryo’s ontdekte Vrij het exacte tijdstip en het proces dat daarbij een rol speelt.
Cruciaal voor de ontwikkeling van de placenta is een goede innesteling van het embryo in het slijmvlies van de baarmoeder, het endometrium. Om die te bestuderen bedachten Vrij en zijn collega’s een ‘innestelings-chip’. Op de bodem van een kweekbakje kweken ze een laagje endometriumcellen van een donor of een patiënt. Dan doen ze er honderd blastoïden bij. „Na twee dagen spoelen we voorzichtig en tellen hoeveel embryo’s er loslaten. Zo weten we hoeveel er goed zijn ingenesteld.” Hiermee testen de onderzoekers bijvoorbeeld welke stoffen en hormonen de innesteling bevorderen of juist tegenwerken. „De eerste ivf-behandeling is slechts bij 35 procent van de vrouwen succesvol, na drie behandelingen is dat 60 procent”, zegt Vrij. In de toekomst zouden hiermee voor elke vrouw persoonlijk de beste omstandigheden gezocht kunnen worden voor innesteling.
Met duizenden tegelijk
De vraag die op ieders lippen brandt is: kunnen de kweekembryo’s uitgroeien tot een echt embryo? Op dit moment niet, zegt Vrij. „De ontwikkeling stopt na twee weken, om nog onduidelijke redenen. Maar elk embryo is net een beetje anders. En we kweken ze met duizenden tegelijk. Theoretisch zou er dan wel een tussen zitten die precies de juiste eigenschappen heeft om door te groeien.” Dat zal hoe dan ook niet passen in de microvakjes. Maar de modelembryo’s van muizen bereiken inmiddels al een stadium dat vergelijkbaar is met halverwege de zwangerschap, zegt Vrij. „Die hebben al een kloppend hart en allerlei organen in aanleg.”
En kunstmatige apenembryo’s leiden – enkele dagen – tot een zwangerschap als ze in de baarmoeder zijn geplaatst.
De snelle ontwikkelingen rond menselijke kunstembryo’s roepen vanzelfsprekend ethische vragen op. De wetenschappers van het MERLN werken nauw samen met ethici van het MUMC+. Die voeren bijvoorbeeld gesprekken met groepen mensen over de vraag of je een kloppend groepje cellen al een hartje kunt noemen. Die ontstaan bij echte menselijke embryo’s ongeveer 21 dagen na de bevruchting.
De kunstembryo’s stoppen met groeien binnen veertien dagen na bevruchting. Dat is óók de leeftijdsgrens tot waar het is toegestaan om échte menselijke embryo’s uit ivf-klinieken te laten doorgroeien, volgens de huidige Embryowet.
Sinds 2022 is er een nieuw wetsvoorstel in de maak, waarin op embryo’s gelijkende structuren (ELS) zijn opgenomen. Daarvoor zouden dezelfde regels moeten gelden als voor echte menselijke embryo’s. Maar tot die wet er is, „mogen we in principe dus nog alles maken met deze technologie”, zegt Vrij.
Lees ook
NRC-redacteur Laura Wismans kreeg een tweeling en ging op zoek naar de genetica daarachter