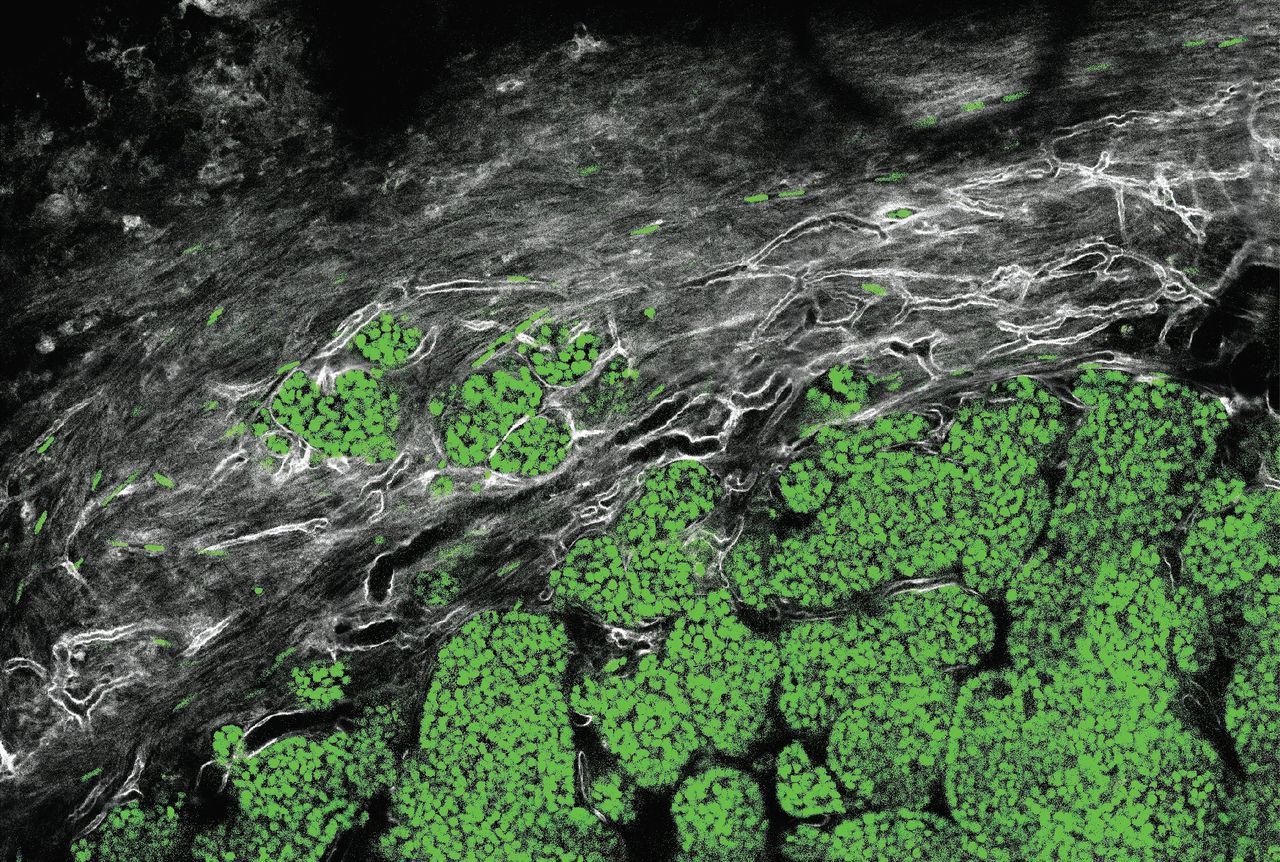
Voor het eerst kunnen onderzoekers live onder de microscoop volgen hoe een tumor zich uitzaait. In zijn kantoor in het Antoni van Leeuwenhoek toont de Utrechtse hoogleraar Jacco van Rheenen een filmpje van een gifgroene tumormassa. Op zijn laptop is te zien hoe de klomp cellen vertakkingen vormt die langzaam richting een rode stroom kruipen – het bloedvat – en deze vervolgens binnendringen.
90 procent van de mensen die aan kanker sterven, overlijdt niet aan de primaire tumor maar aan de uitzaaiingen – ook wel metastasen genoemd. Tumoren die groter worden dan 2 à 3 millimeter moeten bloedvaten aantrekken om verder te groeien, waardoor ze tegelijk kunnen uitzaaien. Dat maakt kanker extra lastig te behandelen. Uitgezaaide tumoren verschijnen vaak in grote aantallen op verschillende plekken, groeien snel en ontwikkelen vlot resistentie tegen bestaande therapieën. De snelgroeiende metastasen verdrukken belangrijke organen, bloedvaten en zenuwen – zo sterk en zo verstorend, dat veel patiënten daaraan bezwijken.
Terwijl er de laatste decennia veel vooruitgang is geboekt in de behandeling van kanker, met name door vroege opsporing en gerichte therapie, is het probleem van uitzaaiing onderbelicht gebleven. Pas de laatste jaren beginnen wetenschappers te begrijpen wanneer en hoe kanker uitzaait. Het traditionele beeld dat kanker het gevolg is van fouten in het dna die ervoor zorgen dat normale cellen zich ongecontroleerd gaan delen, blijkt veel te simpel. Nieuw onderzoek laat zien dat de tumor en het omliggende weefsel een ingewikkeld samenspel aangaan. Zeldzame immuuncellen, signaalstoffen en zelfs de druk van het weefsel rondom de tumor dragen bij aan de uitzaaiing.
Eén nieuwe manier om uitzaaiing te bestuderen is door het proces in levenden lijve te bekijken met een ‘intravitale’ microscoop, zoals die van Van Rheenen. Als onderzoeksleider bij het Nederlands Kanker Instituut en het Oncode Institute legt hij hiermee het gedrag van tumoren in muizen vast. Hij gebruikt moleculaire technieken om verschillende soorten cellen in te kleuren, waarna een infrarode laser het levende weefsel zichtbaar maakt onder de microscoop. Zijn onderzoeksgroep gebruikt de techniek onder andere om te bestuderen hoe moeilijk verwijderbare hersentumoren zich in het brein verspreiden.
Wondhelingsprogramma’s
Van Rheenen laat nog een filmpje zien. Nadat de vertakkingen van de tumor het bloedvat hebben bereikt, laten honderden kleine, groene spikkels zich met het stromende bloed meevoeren. Het lijkt alsof de tumor zich zo gemakkelijk verspreidt, maar dat klopt niet, zegt Van Rheenen. „Slechts een fractie van deze cellen weet zich te nestelen en uit te groeien tot metastase.” In het bloed worden de meeste tumorcellen opgeruimd door de witte bloedcellen van het immuunsysteem, of de cellen bezwijken onder de hoge druk van het vatenstelsel.
Om deze obstakels te overwinnen, moet de tumor eerst het omliggende micromilieu ingrijpend omvormen. Hij legt contact met immuuncellen, met de omgeving buiten de cellen waar zich bindweefsel en eiwitten als collageen bevinden en zelfs met omliggende zenuwen. De samenstelling verschilt per patiënt en orgaan, maar duidelijk is dat het micromilieu essentieel is voor de tumor om het immuunsysteem te omzeilen en te groeien.
Plasticiteit is de bepalende eigenschap: de mate waarin de tumor zichzelf kan aanpassen door andere genetische programma’s te gebruiken. Zo kapen tumoren de codes voor embryonale ontwikkeling en wondgenezing, waarmee ze onder andere het immuunsysteem herprogrammeren. „De tumor spant het immuunsysteem eigenlijk voor zijn eigen karretje”, zegt de Leidse hoogleraar Karin de Visser, net als Van Rheenen onderzoeksleider bij het NKI en het Oncode Institute. „In plaats van de tumorcellen op te ruimen, draaien de immuuncellen een wondhelingsprogramma, waardoor ze bloedvaten gaan aanmaken en groeifactoren produceren.”
Kankeronderzoekers zien steeds vaker dat tumoren zich lichaamseigen processen toe-eigenen. Zo heeft de onderzoeksgroep van De Visser aangetoond dat borsttumoren met bepaalde genetische afwijkingen lokale afweercellen kunnen stimuleren en zo ontstekingsreacties veroorzaken. De ontstekingen helpen de borsttumor vervolgens om uit te zaaien. En daar is niet zomaar een stokje voor te steken, zegt De Visser. „Je bent dan eigenlijk tegen de herstelmechanismen van het lichaam aan het strijden.”
Complex orgaantje
Plasticiteit is nodig voor de groei van primaire tumoren, maar zet tumorcellen ook in beweging. Vrijwel alle tumoren bestaan uit dekweefselcellen die vastzitten aan het omliggende weefsel. Maar door tijdelijk eigenschappen aan te nemen van beweeglijke bindweefselcellen, weten tumorcellen zich los te weken en via het bloed nieuw orgaanweefsel binnen te dringen. Eenmaal in hun nieuwe omgeving, nemen ze weer eigenschappen van dekweefselcellen aan en kunnen ze ook hun stofwisseling aanpassen aan lokale energiebronnen.
De uitzaaiende tumorcellen reizen niet individueel door het lichaam. Ze kunnen zich ook bewegen in groepen, zegt Erik Danen, hoogleraar cancer drug target discovery in Leiden. De cellen laten volgens hem collectief gedrag zien, zoals ook in een vlucht spreeuwen of een school vissen bestaat. Met behulp van modellen uit de fysica van ‘actieve materie’ bestudeert hij samen met biofysici hoe clusters van tumorcellen losbreken en zich naar de bloedvaten begeven.
Tumoren kunnen enzymen uitscheiden en kracht uitoefenen op het omringende weefsel, waardoor ze hun omgeving stijf maken, vertelt Danen. Vervolgens worden de zachte tumorcellen langs een klein lymfevat of zenuwpaadje fysiek naar buiten geperst. „Het is als een vaste stof die onder invloed van drukkracht verandert in een vloeistof en vervolgens als een soort druppel door het weefsel heen kruipt.”
Een tumor is niet een bolletje van dezelfde cellen
Door de omgeving te manipuleren kan een tumor bovendien bepaalde immuuncellen uitsluiten en zich zo verstoppen voor bijvoorbeeld immuuntherapie, blijkt uit onderzoek van Danen. Een beter begrip van de wisselwerking tussen de tumor en het omliggende weefsel zou tot nieuwe manieren kunnen leiden om tumorgroei te beïnvloeden.
Maar de tumor zet nog meer tactieken in. Zo kunnen groepen tumorcellen zich ontwikkelen tot verschillende subtypen die toegespitst zijn op hun eigen taak. Sommige delen van de tumor helpen met het afleiden van het immuunsysteem, terwijl een ander deel zich toelegt op het bouwen van een spoortje richting het bloedvat, waarna de rest kan volgen. Deze specialisatie blijkt volgens recent onderzoek een essentiële eigenschap van tumoren te zijn, zegt Danen. „Een tumor is niet een bolletje van dezelfde cellen, maar eigenlijk een heel complex mini-orgaantje.”
Het lijkt bijna alsof tumoren doelbewust slim gedrag laten zien, maar dit is het gevolg van een jarenlange weg van trial and error, zegt Emile Voest, hoogleraar oncologie aan het UMC Utrecht en internist-oncoloog bij het Antoni van Leeuwenhoek. Zo kan het bij darmkanker wel acht tot twaalf jaar duren voordat de eerste dna-fout uitgroeit tot darmtumor. „In die tijd is de kankercel blootgesteld aan het immuunsysteem en allerlei andere factoren, waardoor die een heel arsenaal aan slimme trucs heeft ontwikkeld.” De selectie gaat ook door wanneer het immuunsysteem de tumorcellen aanvalt en als de tumoren worden blootgesteld aan verschillende vormen van therapie. Dat maakt kanker zo hardnekkig.
Slapende cellen
Nadat de tumorcel (of een cluster hiervan) zich de bloedbaan ingewurmd heeft en in leven is gebleven, reist deze mee totdat hij in een haarvat blijft steken. De vastgelopen cellen kunnen daar direct gaan groeien, of ze kruipen het bloedvat weer uit en nestelen zich in het omliggende weefsel.
Eenmaal ingebed in het weefsel, lijken tumorcellen zichzelf in een jarenlange slaapstand te sussen. In sommige studies suggereren onderzoekers dat deze slaapstand de tumor helpt om onzichtbaar te blijven voor het immuunsysteem. De theorie van slapende tumorcellen kan goed verklaren dat sommige borstkankerpatiënten meer dan vijftien jaar na het verwijderen van hun primaire tumor, toch ineens actieve uitzaaiingen in bijvoorbeeld de longen hebben. De tumor begint pas te groeien wanneer het omliggende weefsel geschikt is. In het geval van longmetastasen kan de tumorgroei aangewakkerd worden door een lokale ontstekingsreactie, veroorzaakt door bijvoorbeeld het inhaleren van sigarettenrook.
Onderzoekers bestuderen momenteel of het mogelijk is deze uitgezaaide tumorcellen in slaap te houden, of te verwijderen door het immuunsysteem een boost te geven. Anderen zijn sceptischer. „Waar hebben we het eigenlijk over als we praten over een slapende cel?”, vraagt Van Rheenen zich hardop af. Slapende cellen zouden zo verstopt zitten en zich zo langzaam ontwikkelen, dat het niet mogelijk is ze waar te nemen of goed te bestuderen.
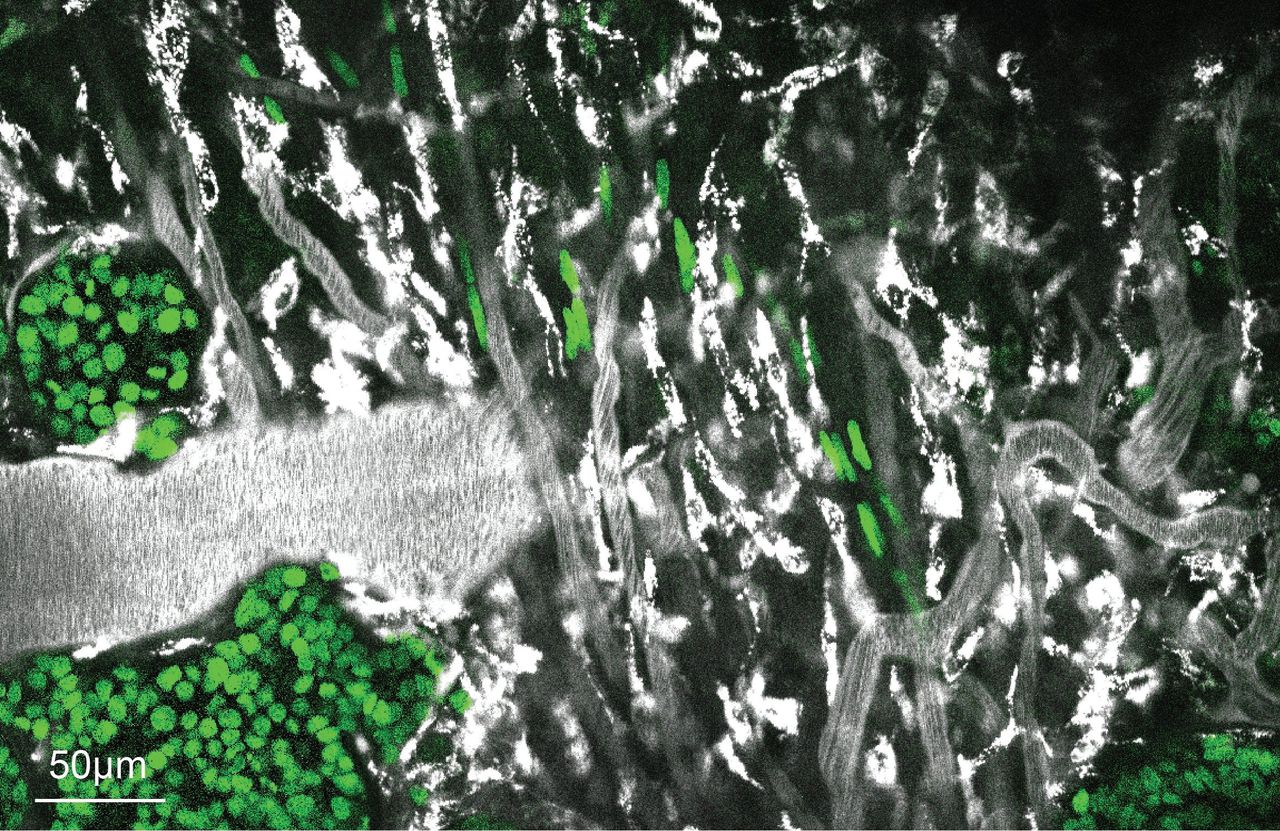
Twee beelden van de ‘intravitale’ microscoop: kankercellen (groen) die bewegen in het zogenoemde micromilieu. In het grijs de bloedvaten.
Foto’s: Jacco van Rheenen/Antoni van Leeuwenhoek
En zo zijn er nog meer tegenstrijdige opvattingen in dit opkomende veld. Zo is er de theorie dat een primaire tumor al vóór het uitzaaien andere organen kan voorbereiden op invasie. De tumor creëert een zogenoemde pre-metastatische niche door signaaleiwitten zoals cytokines uit te scheiden die lokaal het immuunsysteem beïnvloeden. Maar waar de ene onderzoeker wel voldoende bewijs ziet voor deze theorie, of voor het bestaan van slapende cellen en tumorclusters, beweert de ander dat er nog te veel onduidelijk is.
Veel van het fundamentele metastase-onderzoek heeft geen directe klinische toepassing, en dat maakt dat er lange tijd weinig aandacht voor is geweest. Wanneer een patiënt zich bij een ziekenhuis meldt met een primaire tumor, is het snel behandelen daarvan de beste manier om uitzaaiingen te voorkomen. Onderzoekers richten zich daarom liever op het bestrijden van primaire tumoren en op vroegdiagnostiek.
Maar toch biedt het onderzoek handvatten voor betere behandelingen. Zo kan het begrijpen van tumoraggressiviteit overbehandeling voorkomen, en ook bestaande therapieën tegen kanker effectiever maken. „We zien steeds duidelijker dat tumoren afhankelijk zijn van hulptroepen uit hun omgeving, en dat geeft mogelijkheden om op zoek te gaan naar hun achilleshiel”, zegt Van Rheenen. Als voorbeeld noemt hij de zogeheten checkpointremmers, een klasse geneesmiddelen die de afgelopen jaren geregeld succesvol is. Om zichzelf te beschermen, gebruiken tumoren vaak bepaalde eiwitten die het immuunsysteem afremmen. Door deze ‘checkpoints’ te remmen, lukt het T-cellen en andere immuuncellen beter om de tumor te vernietigen.
Gepersonaliseerde therapie
Momenteel onderzoekt Van Rheenen samen met De Visser wat de rol van eosinofielen is bij agressieve borstkanker. Deze relatief onbekende soort afweercellen treffen onderzoekers aan in borstkankermetastasen wanneer immuuntherapie met checkpointremmers goed aanslaat. Maar wat die eosinofielen daar doen? „Met de intravitale microscoop van Jacco van Rheenen willen we ze visualiseren”, zegt De Visser. „Wat voor fysieke interactie hebben ze met tumorcellen en andere afweercellen? En wat voor stofjes scheiden ze eigenlijk uit?”
Immuuntherapie met checkpointremmers heeft bij ongeveer een op de vijf borstkankerpatiënten effect. Als eosinofielen inderdaad bijdragen aan de immuunreactie, dan willen de twee hoogleraren kijken of het mogelijk is deze afweercellen te stimuleren, waardoor de behandeling mogelijk bij meer patiënten aanslaat.
De komende decennia zullen er meer van dit soort gerichte therapieën verschijnen die kanker indirect aanpakken, verwacht Van Rheenen. „Als je dit combineert met chemotherapie of bestraling, dan kun je een tumor van meerdere kanten insluiten.” Uit onderzoek blijkt steeds duidelijker dat verschillende vormen van kanker sterk van elkaar kunnen verschillen, waardoor een one size fits all-aanpak ver weg lijkt. Het is waarschijnlijker dat artsen in de toekomst patiënten behandelen met gepersonaliseerde therapie: een samenstelling van behandelvormen, afgestemd op de patiënt en de eigenschappen van de tumor.
Maar in de tussentijd zijn er nog grote, gapende gaten in de kennis van metastase. Omdat uitzaaiingen vrijwel onzichtbaar zijn, en zich ontwikkelen over een verloop van meer dan tien jaar, zijn ze moeilijk te bestuderen en begrijpen we veel nog niet, zegt Van Rheenen. Zo meldden sommige patiënten zich in het ziekenhuis met uitgezaaide kanker, terwijl er van een primaire tumor geen spoor te bekennen is. „En waarom zaaien borstkankercellen wél uit naar de lever, hersenen en het beenmerg, maar zelden naar de andere kant van de borst? We hebben eigenlijk nog geen idee.”
Uitzaaiingen
Belangrijkste doodsoorzaak
- 38.000
- Een vijfde van de kankerpatiënten blijkt bij de diagnose al uitzaaiingen te hebben. Volgens het Integraal Kankercentrum Nederland gaat het daarbij om jaarlijks 38.000 mensen. Longkankerpatiënten vormen de grootste groep met uitgezaaide kanker, en jaarlijks overlijden er ruim 10.000 van hen aan deze ziekte. Na dementie is kanker daarmee de belangrijkste doodsoorzaak in Nederland. In totaal overleden er in 2022 meer dan 170.000 mensen, van wie 28 procent aan kanker.
- 24.000
- Met meer dan 24.000 patiënten is huidkanker de meest voorkomende vorm van kanker in Nederland. Daarop volgen borst-, long- en prostaatkanker met rond de 15.000 diagnoses per jaar, en darmkanker met 12.000 diagnoses. In 2023 kregen in totaal ruim 128.000 Nederlanders kanker.
- 5
- Momenteel is vijf jaar na de diagnose nog twee derde van de kankerpatiënten in leven. Dit is sterk gestegen ten opzichte van 1990: toen was dit nog 43 procent. Maar de overlevingskans bij uitgezaaide kanker is in de afgelopen tien jaar nauwelijks verbeterd, en de vijfjaarsoverleving van deze patiënten ligt op ongeveer 15 procent. Zorgverleners richten zich bij deze patiënten daarom veelal op palliatieve zorg, waarbij ze de levenskwaliteit van de patiënt verbeteren.