N.B. Het kan zijn dat elementen ontbreken aan deze printversie.
Een nieuw middel in de VS tegen alzheimer biedt hoop, maar werkt nauwelijks. Zullen er ooit medicijnen tegen de ziekte komen?

Beeld Lynne Brouwer
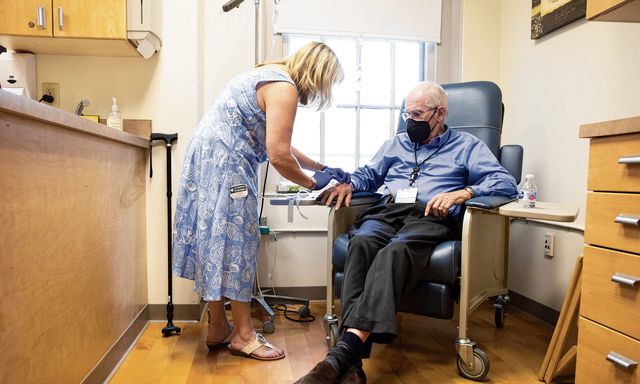
Zijn hele handrug stond volgeschreven met telefoonnummers en afspraken en telefoontjes met klanten. „Anders onthield ik ze niet”, zegt René, eigenaar van een transportbedrijf in Limburg. Hij zit aan een tafel in een onderzoekskamer van het Brain Research Center in Den Bosch met zijn vrouw, Yvonne. Aan een standaard naast hem hangt een infuuszak die druppel voor druppel leegloopt in zijn aderen. Wat er in de zak zit weet hij pas over twee jaar: een experimenteel medicijn of gewoon water met zouten. René is proefpersoon in een studie naar een mogelijk medicijn tegen de ziekte van Alzheimer.
Yvonne merkte als eerste dat er iets niet klopte. „Fouten in facturen herkende hij niet meer, verslagen zocht hij ineens weer op in oude klappers in plaats van in het computersysteem waarin ze al vijftien jaar worden bewaard.” Inloggen lukte sowieso niet meer, want wat was het wachtwoord? Daarvoor moest hij steeds haar bellen. „Kom naar de zaak, vroeg hij soms, het is zo druk hier. Dat was het dan helemaal niet”, vertelt ze, „maar wel te druk voor hém.”
Niet geschoten is altijd mis, verder kun je niets doen
René alzheimerpatiënt
Zestig jaar is hij, vorig jaar constateerden artsen bij hem beginnende alzheimerdementie. Veel te jong, vonden hij en Yvonne. En goede medicijnen zijn er niet. Dus toen er een studie was met een experimenteel medicijn hoefde hij geen twee keer na te denken. „Niet geschoten is altijd mis, verder kun je niets doen.”
Elke maand rijden ze vanuit Limburg naar Den Bosch voor lichamelijk onderzoek en een nieuwe dosis. Ook vandaag meten de onderzoekers eerst zijn bloeddruk, ze maken een hartfilmpje, luisteren naar de longen en schijnen met een lampje in zijn ogen. Dan wordt het infuus aangelegd. Het moet twee uur lopen, en daarna moet hij voor de zekerheid nog twee uur blijven. Het echtpaar komt de middag door met praten, kaarten en mens-erger-je-nieten.
Vooral oudere mensen
Vergeetachtigheid is een van de eerste symptomen van de ziekte van Alzheimer. Nadenken wordt steeds moeilijker, net als mensen herkennen, informatie opnemen en onthouden en dingen begrijpen. Er kan verwarring zijn over locaties en tijden, soms ontstaat onrust en agressie.
Er zijn meer dan vijftig hersenziekten die tot dementie kunnen leiden, alzheimer is bij 70 procent van de patiënten de oorzaak. In Nederland hebben ongeveer 200.000 mensen de ziekte. Dementie treft vooral oudere mensen: één op de tien 65-plussers krijgt het, onder 85-plussers is dit zelfs één op de twee.
Met de vergrijzing zullen steeds meer mensen deze ontluisterende ziekte krijgen. Daarom zijn wetenschappers al decennia op zoek naar medicijnen. Maar die zoektocht heeft tot nu toe bar weinig opgeleverd. Uit honderden afgeschoten kandidaten zijn er nu vier middelen op de markt. Die kunnen de symptomen wat remmen, bij sommige patiënten, maar ze genezen de ziekte niet. Het ziekteproces gaat door.
/s3/static.nrc.nl/images/gn4/stripped/data97452517-e8b491.jpg|https://images.nrc.nl/V2AWv3vRMdR5TFwQFOJuK5a8Alw=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data97452517-e8b491.jpg|https://images.nrc.nl/jHPHhXf_zrGPG2r61evr-aeflDE=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data97452517-e8b491.jpg)
/s3/static.nrc.nl/images/gn4/stripped/data97452530-b7e6bf.jpg|https://images.nrc.nl/10JjtKgs_QC0jauOTbtKi8O1SMs=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data97452530-b7e6bf.jpg|https://images.nrc.nl/jT533AmLogZzSZh0lCiemqn_Bng=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data97452530-b7e6bf.jpg)
Groot was dan ook de opwinding over een nieuw medicijn dat het Amerikaanse medicijnagentschap FDA in januari goedkeurde. Het middel, lecanemab van de fabrikanten Esai en Biogen, vertraagt de cognitieve achteruitgang bij mensen in een vroeg stadium van alzheimer – een beetje. Lecanemab werkt anders dan de bestaande middelen. Het is een antistof tegen eiwitklonters in de hersenen die kenmerkend zijn voor alzheimer: de plaques van het eiwit bèta-amyloïde.
Toch was de verbijstering van wetenschappers over de goedkeuring groot. Aan de doorslaggevende studie deden ruim 1.700 patiënten mee. De helft die het middel elke twee weken per infuus kreeg toegediend, was anderhalf jaar later 1,21 punten achteruitgegaan op een dementietest, de deelnemers die placebo kregen 1,66 punten – een verschil van 0,45 punten. De maximale score op die test is 18 punten, bij aanvang scoorden alle deelnemers 3,2 punten.
Een zeer teleurstellend resultaat, vindt Marcel Olde Rikkert, hoogleraar geriatrie en coördinator van het Radboudumc Alzheimer Centrum in Nijmegen. „Patiënten en hun naasten zullen daar niets van merken in het dagelijks leven. Daarvoor moet het verschil op die test minimaal 1 of 2 punten zijn. Bovendien treden bij 15 procent van de deelnemers ernstige bijwerkingen op, hersenzwelling en hersenbloedingen, en is het middel erg duur. Geen aanwinst voor het veld, kortom.”
Lecanemab is het tweede middel in korte tijd dat de FDA toeliet: een vergelijkbaar mager presterend middel, aducanumab, kwam er in 2021 op de markt – ook tot verbijstering van velen, inclusief de wetenschappelijke adviescommissie van de FDA zelf. In Europa zijn beide middelen niet op de markt: het medicijnagentschap EMA gaf een negatief advies over aducanumab en moet zich nog buigen over lecanemab.
Lees ook: Medicijnwaakhond VS keurt omstreden alzheimermiddel goed
Al meer dan een eeuw bekend
Toch is er reden om verheugd te zijn, vindt neuroloog Niels Prins. „Wetenschappelijk gezien is dit voor het eerst een hoopgevende aanwijzing dat afremmen van de ziekte mogelijk is.” Prins is directeur van het Brain Research Center, waar René een proefpersoon is. Hij leidt klinisch onderzoek naar alzheimermedicijnen, in opdracht van farmaceutische bedrijven.
Waarom is het zo lastig om middelen tegen alzheimer te vinden? Al meer dan een eeuw is de ziekte bekend. En inmiddels hebben wetenschappers veel inzicht vergaard in de moleculaire processen die zich diep in de hersenen afspelen bij de ziekte. Maar waardoor de ziekte ontstaat, is nog altijd niet goed duidelijk. Het overheersende idee is dat het eiwit bèta-amyloïde er een belangrijke rol bij speelt.
In elke gezonde zenuwcel zit het grote eiwit APP (amyloid-bèta precursor protein) op de plek waar informatie wordt doorgegeven aan een volgende zenuwcel. Het wordt door enzymen in kleinere fragmentjes geknipt, waarbij het eiwit bèta-amyloïde ontstaat. Een zenuwcel werkt dat naar buiten. Daar wordt het normaal gesproken opgeruimd, maar soms gebeurt dat te weinig of ontstaat er te veel.
„Het zijn eerst nog losse fragmentjes, dan korte ketens”, legt Prins uit. „Vervolgens vormen ze grotere ketens, zogenoemde protofibrillen. Die zijn nog oplosbaar. Uiteindelijk vormen zij dikke, onoplosbare amyloïdeplaques tussen de hersencellen.” Bij alzheimer begint dat vaak in het geheugengebied, de zogeheten hippocampus.
Stuk voor stuk gefaald
Het is het begin van een kettingreactie. Er ontstaan ontstekingsreacties, en in de hersencellen vormt een ander eiwit, tau, een wirwar van strengen. Door ophopingen van bèta-amyloïde en tau sterven hersencellen. Daarnaast spelen andere processen een rol, zoals vaatschade en veroudering, en er zijn genetische factoren.
„We weten nog niet goed genoeg waarop een middel moet aangrijpen om deze cascade te stoppen”, zegt Prins. Zowel de protofibrillen als de plaques veroorzaken geheugenproblemen bij muizen en mensen, blijkt uit onderzoek. „Lecanemab bindt aan die protofibrillen, dat lijkt een manier om het ziekteproces te beïnvloeden, want er ontstaan minder plaques.”
De ophopingen van bèta-amyloïde en tau en het verlies van hersencellen zijn drie biologische kenmerken die samenhangen met de ziekte van Alzheimer. In studies zijn deze drie tegenwoordig ook criteria voor de diagnose – sinds een jaar of tien zijn deze eiwitten op hersenscans en in hersenvocht aan te tonen. „Iemand kan dus ook al die biologische fenomenen hebben, maar nog geen cognitieve klachten”, aldus Prins.
De ophopingen lijken samen te hangen met de cognitieve achteruitgang. Maar of ze de oorzaak ervan zijn, is nog niet duidelijk. Sommige wetenschappers denken dat bèta-amyloïde slechts een bijproduct is. Want ook in de hersenen van ouderen die géén dementieklachten hebben zitten soms amyloïdeplaques. En de bijna veertig kandidaat-geneesmiddelen tegen bèta-amyloïde die tot nu toe zijn bestudeerd, faalden stuk voor stuk: van allerlei typen antilichamen tot middelen die samenklontering moesten voorkomen of enzymen remmen die APP opknippen. Soms verlaagden ze de hoeveelheid amyloïdeplaques, maar nooit zorgden ze voor geheugenverbetering.
Ik stond ervan te kijken hoe fel die discussie gevoerd wordt
Bert Theunissen hoogleraar wetenschapsgeschiedenis
Het uitblijven van duidelijke resultaten leidde tot een felle richtingenstrijd tussen voor- en tegenstanders van de amyloïdehypothese. Bert Theunissen, hoogleraar wetenschapsgeschiedenis aan de Universiteit Utrecht, onderzocht het verloop van het conflict. Sinds 2000 vliegen de twee kampen elkaar regelmatig in de haren via de wetenschappelijke tijdschriften.
„Ik stond ervan te kijken hoe fel die discussie gevoerd wordt. Er vallen woorden als ‘de amyloïdemaffia’. In de negentiende eeuw konden wetenschappers ook flink schelden, maar dit heb ik ze onderling niet vaak zien doen.”
Theunissen wijt het aan de grote belangen. „Er gaan miljarden in om, hele instituten en reputaties zijn op de amyloïdehypothese gebouwd. Als je een andere hypothese aanhangt, krijg je minder makkelijk fondsen en plek in wetenschappelijke tijdschriften.”
De lange vruchteloze zoektocht werpt de vraag op of al die miljarden niet beter aan zorg besteed moeten worden, of aan preventie. Prins vindt van niet. Hij verloor zijn eigen vader drie jaar geleden aan alzheimer. „Een pijnlijk proces. Ik vind het een morele plicht om te blijven zoeken naar medicijnen.”
Prins ziet de resultaten met lecanemab als een ondersteuning van de amyloïdehypothese. „Waarschijnlijk probeerden we met die eerdere middelen het verkeerde amyloïde weg te halen.” Maar het is een begin. „Wat we nodig hebben is een goedkoop, veilig middel dat het ziekteproces verandert, in een tabletje dat je kunt slikken.” Die middelen zijn onderweg, denkt hij. Begin 2022 liepen er wereldwijd 143 klinische studies, waarvan 31 in de laatste fase.
Kleine moleculen
Zijn hoop is gericht op zogeheten small molecules die nu veel worden onderzocht. Dat kunnen allerlei moleculen zijn: kleine suikers, aminozuren, vetten of andere chemische stofjes. „Een antilichaam, zoals lecanemab, is een groot eiwit. Kleine moleculen kunnen het brein makkelijker bereiken en zijn goedkoper te maken.”
Prins verwacht binnen afzienbare tijd een bruikbaar middel. In zijn Brain Research Center lopen diverse onderzoeken met small molecules tegen bepaalde vormen van amyloïde. In de studie waaraan patiënt René meedoet wordt een middel getest tegen tau. Prins: „Je weet natuurlijk nooit of die middelen de eindstreep halen, maar die small molecules lijken veelbelovend.”
Olde Rikkert in Nijmegen denkt daar anders over. Hij beschouwt de complete cascade van bèta-amyloïde en tau als een radertje in een groter geheel. Veroudering is het onderliggende proces, denkt hij. „Er zijn zo’n negen processen die cellulaire veroudering aansturen. Zo spelen de mitochondriën een belangrijke rol, de energiefabriekjes in een cel. En ook de gevoeligheid voor het hormoon insuline dat de bloedsuiker regelt, lokale dna-veranderingen en ontsteking. Met leefstijlaanpassingen of medicijnen kun je daarop ingrijpen. Met regelmatige inspanning of periodiek vasten bijvoorbeeld, of met bepaalde diabetesmedicijnen.”
Het duurt nog een hele tijd voor we weten hoe het zit
Die gedachte lijkt voet aan de grond te krijgen in het veld. Deze maand publiceerde Olde Rikkert met collega’s uit uiteenlopende vakgebieden een computermodel van dementie waarin ze wetenschappelijke gegevens van alle mogelijke bijdragende schadelijke oorzaken samenvoegden om simulaties te kunnen doen. Roken, slaaptekort, depressie, opleidingsniveau, ontsteking, sociale contacten, lichaamsbeweging – alles zit erin. „Dit onderzoek gaat uit van een heel ander paradigma. Dat deze studie is aanvaard door het meest gezaghebbende tijdschrift in het onderzoeksveld is een mijlpaal. Het tekent een kentering in het denken over de ontstaanswijze van de ziekte.”
Zelfs mensen die beginnende alzheimer hebben zouden met leefstijlaanpassingen de ziekte kunnen vertragen, verwacht Olde Rikkert, zoals stoppen met roken en alcohol drinken. „Maar de bewijzen komen nog niet uit studies bij mensen, laat staan patiënten, dus het duurt nog een hele tijd voor we weten hoe het zit.”
Die tijd heeft René niet. Hij hoopt vurig dat hij in de groep patiënten zit bij wie het experimentele medicijn in de infuuszak zit, en dat dat zal werken. Zelf heeft hij het idee dat het werkt. „Ik ga niet achteruit.” De dag doorkomen, dat vindt hij nog het moeilijkste met zijn ziekte – hij heeft altijd zes dagen per week gewerkt. De vrachtwagens van de zaak mag hij niet meer rijden, maar zijn auto gelukkig nog wel. Zo kan hij naar Duitsland voor een jachtcursus met hun vier maanden oude teckel Yara. „Je gaat er een keer per week naartoe, je loopt lekker buiten, en daarnaast moet je thuis veel oefenen. Die cursus duurt drie jaar. Daarna zien we wel weer verder.”


/s3/static.nrc.nl/images/gn4/stripped/data135012506-b0c74d.jpg|https://images.nrc.nl/3ZoYRVZogZ0hsk8KNhA15YiA-Bo=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data135012506-b0c74d.jpg|https://images.nrc.nl/Gg4CjceZccTWw2nPt4P6mMjVf-E=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data135012506-b0c74d.jpg)
/s3/static.nrc.nl/images/gn4/stripped/data135013442-a9b316.jpg|https://images.nrc.nl/x4R3WCRB_sOhnN8CmhilYXonJ6o=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data135013442-a9b316.jpg|https://images.nrc.nl/8o3pKaqjObm95unIYygsZKzzWdA=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data135013442-a9b316.jpg)
/s3/static.nrc.nl/images/gn4/stripped/data135012362-6f1cf3.jpg|https://images.nrc.nl/f0ugN69P9qo8ADDZdbfkLP3f4BA=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data135012362-6f1cf3.jpg|https://images.nrc.nl/H9_6kWC3OccxdkfZRZ9E_zWcc3Y=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data135012362-6f1cf3.jpg)




