N.B. Het kan zijn dat elementen ontbreken aan deze printversie.
Luister naar
07:46
Hersens, hart, lever, darm en nier: menselijke organen kun je op een chip laten groeien. Deze techniek helpt het gebruik van proefdieren te verminderen en opent de deur naar geneesmiddelen voor nu nog ongeneeslijke ziektes. De magie van het kunstmatig lichaam.
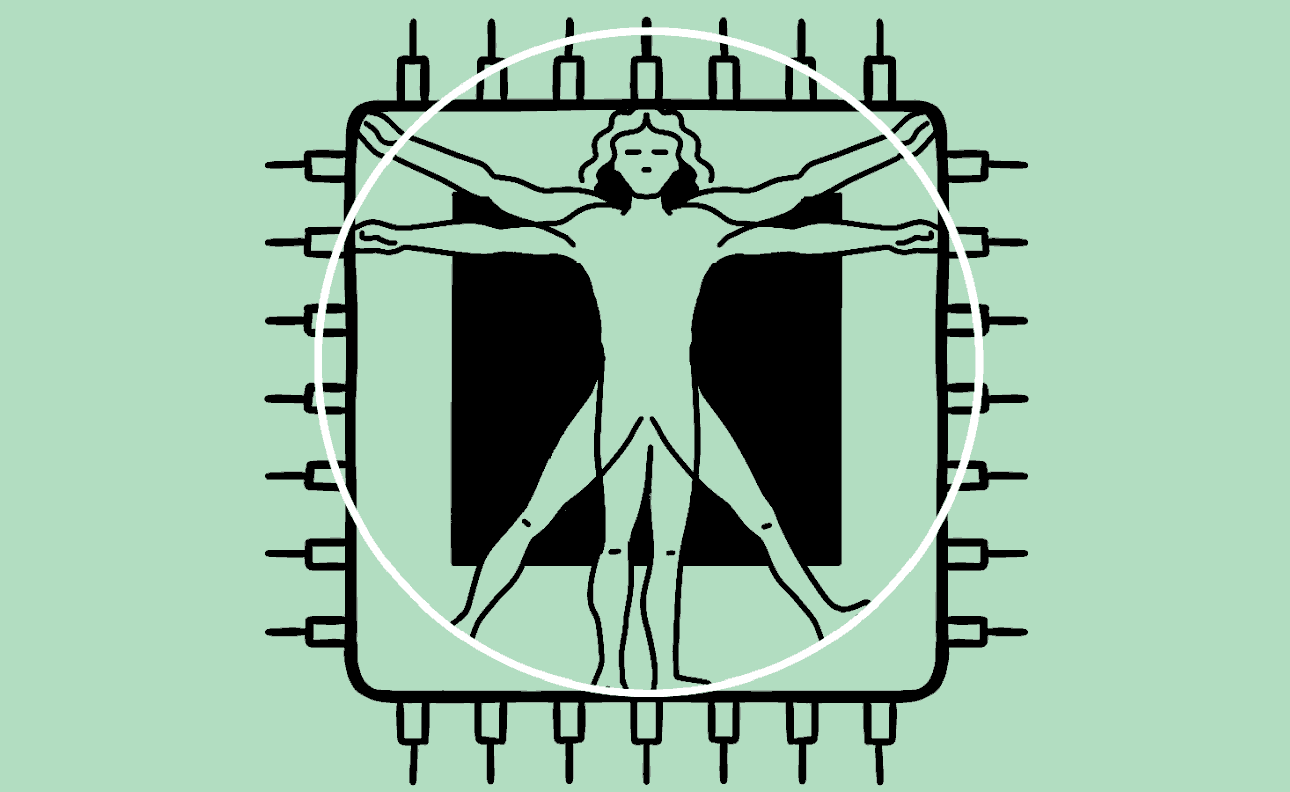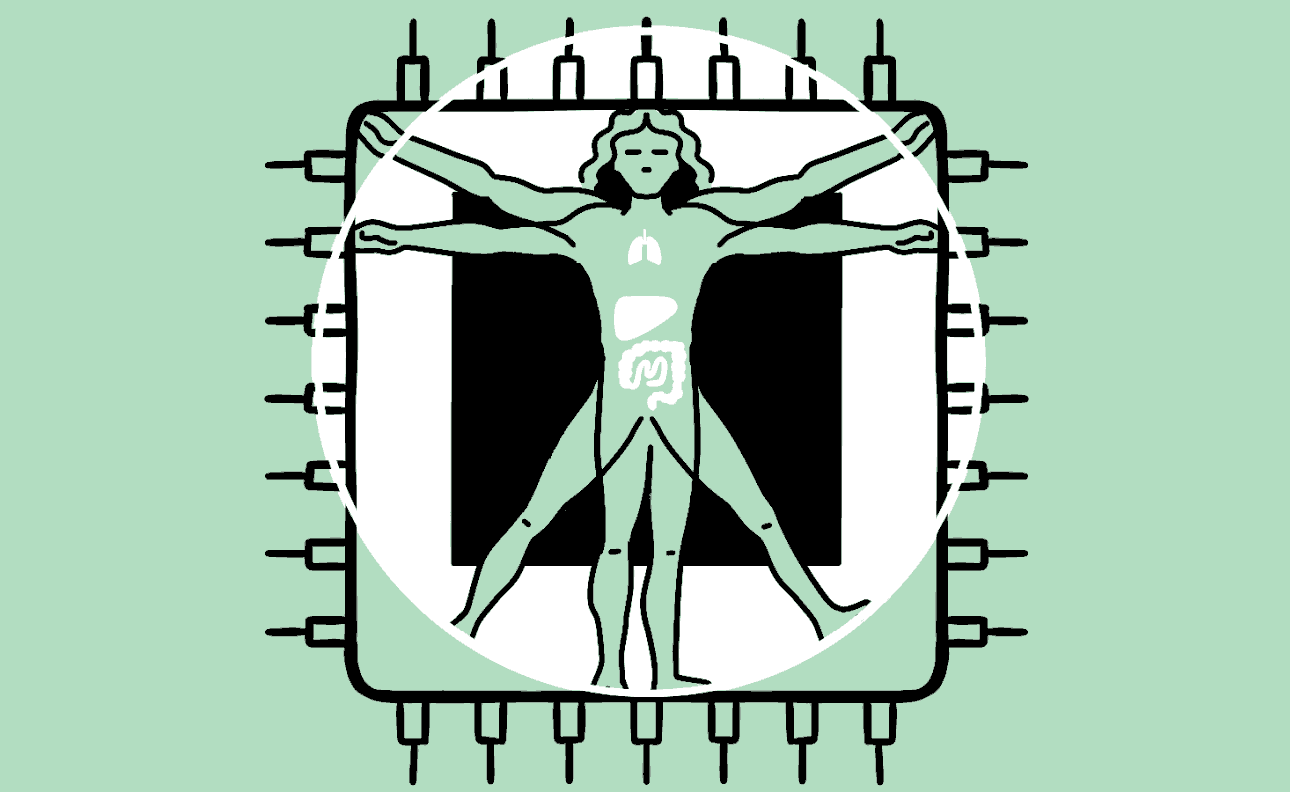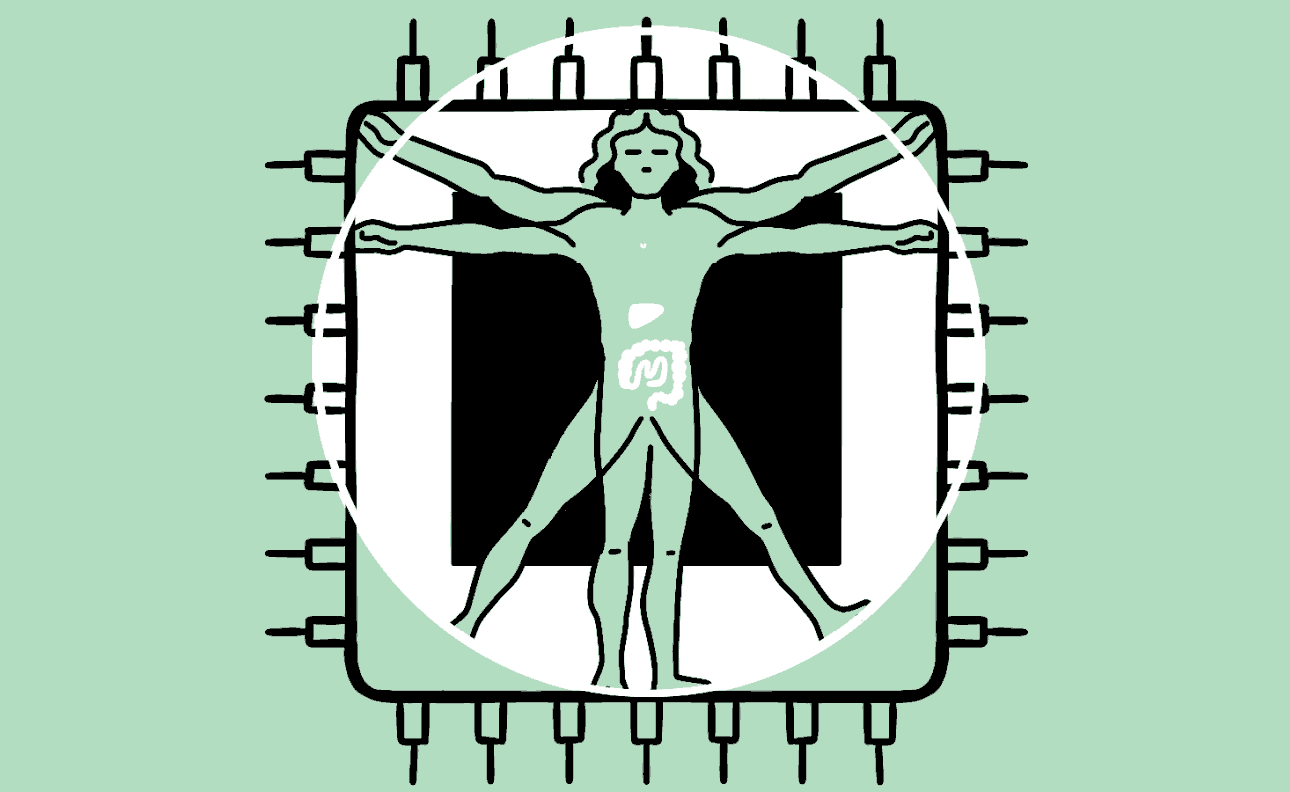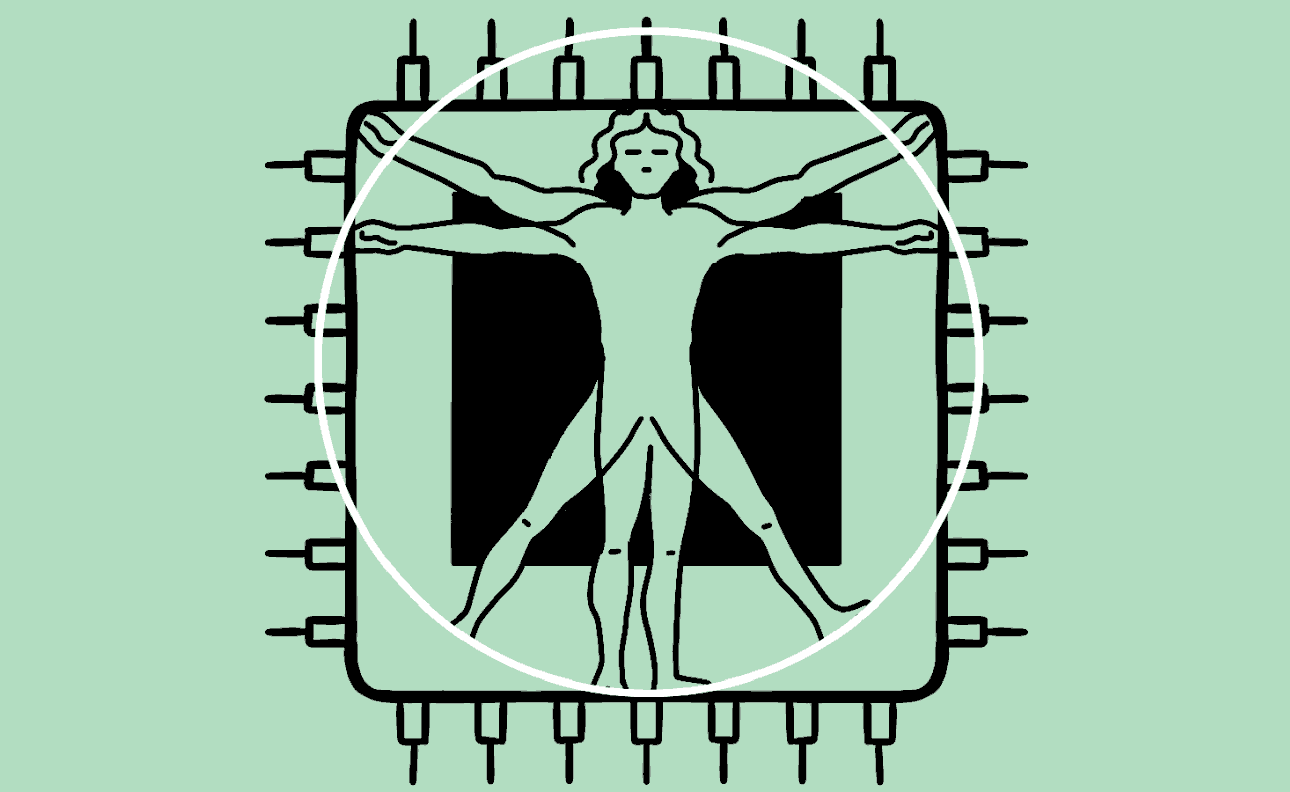
Animatie Roel Venderbosch
Het lijkt een chip zoals elke andere: een plat vierkantje met wat gesoldeerde verbindingen en elektronica. Maar in het midden prijkt een plastic zwembadje waarin zich een klein wonder voltrekt. Giet je dit kleine bakje vol met een fysiologische zoutoplossing, dan kan er een stukje menselijk brein in groeien. Of een stukje long, hart, darm, lever of nier, gekweekt uit stamcellen. Het is orgaanvlees, op een bedje van silicium.
Deze mini-organen zijn dagelijkse kost voor Chiara Diacci van het Vlaamse onderzoeksinstituut imec en specialist in bioelektronica. Op een tafel in het Antwerpse congrescentrum toont Diacci de chips waaraan zij met haar collega’s werkt: halfgeleiders die meten hoe menselijke weefsels op medicijnen reageren. Het is een digitale revolutie in de dop, waarin niet kunstmatige intelligentie maar het kunstmatige lichaam de hoofdrol speelt. „Straks heeft iedereen zijn eigen Mini-Me”, zegt Diacci. Ze verwijst naar komediefilm Austin Powers (‘Yeah baby!’), waarin slechterik Dr. Evil zich liet vergezellen door een kleine kloon van zichzelf.
Op het jaarlijkse congres van imec, dat afgelopen week in Antwerpen gehouden werd, draaide alles om chips. En dan vooral om de chips die extra rekenkracht bieden, voor de heilige graal van Silicon Valley: artificiële intelligentie die zich kan meten met het menselijk brein. Er worden honderden miljarden dollars gepompt in AI-start-ups en alwetende assistenten, waarvan twijfelachtig is of ze ooit geld gaan opleveren.
‘OoC’ (Orgaan op Chip) is een minder sexy afkorting dan ‘AI’, maar lost een veel tastbaarder probleem op. Het gaat om mensen- en dierenlevens. Met de testdata van mini-organen kunnen farmaceutische bedrijven de ontwikkeling van nieuwe geneesmiddelen versnellen. Dat proces duurt nu nog jaren, is schreeuwend duur en extreem inefficiënt.
Ongezonde industrie
Hoe economisch ongezond de farmaceutische industrie is, blijkt uit de cijfers van onderzoeksbureau Deloitte: in 2022 staken de twintig grootste bedrijven 139 miljard dollar in medicijnontwikkeling, en die investering had een rendement van 1,2 procent – het laagste niveau sinds 2010.
Door aangescherpte regulering – bedoeld om gevaarlijke missers met goedgekeurde medicijnen te voorkomen – belanden er minder geneesmiddelen uit het lab op het nachtkastje. De regels zijn te streng voor de huidige testmethoden, en daardoor halen veel potentiële medicijnen de eindstreep niet.
Organen op chips helpen de effectiviteit van preklinische studies te vergroten en verminderen de inzet van proefdieren. Volgens Animal Rights worden wereldwijd 115 miljoen proefdieren ‘gebruikt’, in Nederland gaat het per jaar om een half miljoen dierproeven.
Voor veel geneesmiddelen geldt dat dieren geen goede indicatie geven van het effect op de mens. Biomedicus Dries Braeken van imec legt het uit: „Geneesmiddelen worden complexer, zoals immuuncellen die tumoren aanvallen. Dat kun je moeilijk testen op een muis, maar wel met een orgaanchip die de interactie met het immuunsysteem nabootst.”
Barrière in de hersens
Een bakje met enkele tienduizenden hersencellen levert geen werkend brein op – een menselijke hersenpan telt wel 86 miljard cellen. Maar je kunt wel bepaalde functionaliteit nabootsen, zoals de bloed-brein-barrière.
In tegenstelling tot alcohol of cafeïne hebben medicijnen moeite met die natuurlijke grens tussen hersens en bloedbaan. Dat belemmert de bestrijding van hersenziektes als alzheimer en parkinson. Als je de bloed-brein-barrière veilig kan doorbreken – medicijnen via een soort ‘Paard van Troje’ naar binnen smokkelt – opent dat nieuwe mogelijkheden.
Braeken noemt ALS, de slopende zenuw-spierziekte, als voorbeeld. „Er is een Amerikaanse therapie die werkt bij een fractie van de ALS-patiënten, waarbij het ziekteproces deels teruggedraaid lijkt te worden. Zij moeten wel elke maand geïnjecteerd worden, in de hersens, door de schedel heen. Voor grootschalige toepassingen moet de drug delivery beter.”
De bloed-brein-barrière is een van de vele heilige gralen van de OoC-ontwikkeling. Naast de grote organen worden ook specifieke lichaamsfuncties nagebouwd, zoals een retina-op-een-chip om medicijnen tegen oogziektes te testen, of een gehoororgaan-op-een chip om doofheid te bestrijden.
De Amerikaanse FDA stimuleert sinds vorig jaar het gebruik van orgaanchips. Dat is een belangrijke stimulans voor commerciële toepassingen. Nederlandse bedrijven zoals Mimetas uit Leiden storten zich op die markt. Ook het Nationaal Groeifonds stak – toen het nog niet om zeep geholpen was door de aanstaande coalitie – miljoenen in de ontwikkeling van ‘miniatuur diagnostiek’.
Nederlandse wetenschappers zijn goed in orgaan-op-chips , weet Andries van der Meer. Hij is professor aan de Universiteit Twente, leidt daar het OoC-expertisecentrum, en is voorzitter van de Europese Organ-on-Chip Society. Maar de orgaanchip is geen wondermiddel, benadrukt hij. „De techniek zal zich stapsgewijs moeten bewijzen. De conventionele methodes met gekweekte cellen, weefsels en ook proefdieren zullen niet volledig vervangen worden.”
Aan de commerciële potentie twijfelt Van der Meer niet. Het kost gemiddeld 2,3 miljard dollar om een geneesmiddel op de markt te brengen en de grootste kosten zitten in de klinische proeven, aan het einde van het ontwikkelproces. Meer dan 80 procent van de kandidaatmedicijnen valt in dat stadium alsnog af. Als je het succespercentage een fractie verbetert, scheelt dat veel geld.
Body-on-a-chip
Er is nog standaardisatie nodig, voor sensordata en voor de maten van de chips: die moeten passen bij de methodes die farmaceutische laboratoria nu gebruiken. Een standaard voor het koppelen van de chips helpt om ‘multi-organ’ chips te bouwen, bijvoorbeeld een stelsel met darmen en nieren. Dat zou, net als bij computers, een kwestie van plug and play moeten zijn.
Andere opties: een ‘ziekte-op-een-chip’, een ‘patiënt-op-een-chip’, om medicijnen op maat te maken. Deze persoonlijke aanpak is kostbaar en het vergt maanden om stamcellen te herprogrammeren tot mini-organen. Je zou volgens Van der Meer een live orgaanchip moeten hebben die je constant bijhoudt, want de chips ‘leven’ maar enkele maanden. Dat is de farmaceutische toekomst: iedereen een eigen body-on-a-chip, een Mini-Me als persoonlijk proefdier.
Het is een fantastisch vakgebied, vindt Van der Meer, op het snijvlak van technologie en biologie. Met één klein nadeel: sommige orgaantypen hebben om de dag voedingsstoffen nodig, zoals glucose. „Dat betekent dat je ook in het weekend naar het laboratorium moet, om de chips te voeren.”




/s3/static.nrc.nl/images/gn4/stripped/data134707599-d00030.jpg|https://images.nrc.nl/vpnUM9Q_Xyiu79vZOXD4XJgvcUw=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707599-d00030.jpg|https://images.nrc.nl/5rbSD4xqDO6K-FYQLgabwoiwtWY=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707599-d00030.jpg)

/s3/static.nrc.nl/images/gn4/stripped/data134707695-1aa407.jpg|https://images.nrc.nl/f2Fl3ts7H3chNrdocE5deTBHtRA=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707695-1aa407.jpg|https://images.nrc.nl/-HcVpkITZ8SF5zpaos26uxvoXzw=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707695-1aa407.jpg)
/s3/static.nrc.nl/images/gn4/stripped/data134707527-9b78f0.jpg|https://images.nrc.nl/egHoArt1hjT4jJ8WiblaXhtbWS4=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707527-9b78f0.jpg|https://images.nrc.nl/GrOOxAKkbmpJ1ibPH49M03Bbh9w=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707527-9b78f0.jpg)
/s3/static.nrc.nl/images/gn4/stripped/data134707752-336633.jpg|https://images.nrc.nl/gGCDGouxSp__yT0ujUsc_h7fE20=/1920x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707752-336633.jpg|https://images.nrc.nl/rkSbvw4jFG04G4bUuF4wfLFkSgs=/5760x/filters:no_upscale()/s3/static.nrc.nl/images/gn4/stripped/data134707752-336633.jpg)



